化学で役立つ公式7選をご紹介!
高校生のみなさん、こんにちは。
バイオ・再生医療学科の和田です。
「高校の化学が難しい、何を覚えたらいいか分からない」という方に向けて、
「バイオの業界」を目指すなら覚えておいたほうがいいオススメの公式や計算式などを3つご紹介しようと思います。
あくまで、「化学基礎」を学ぶうえにおいて絶対重要だと思われる計算式ですのでご注意ください。

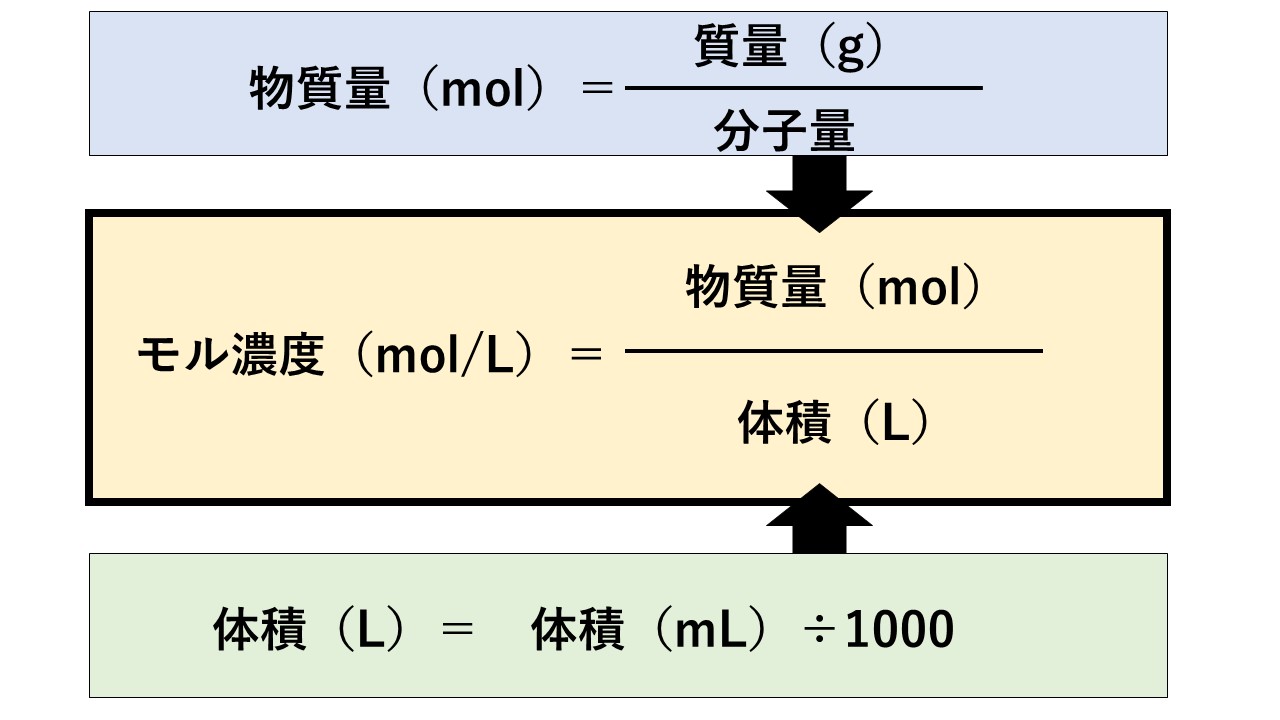
モル濃度(mol/L)の計算
物質量のことをモル(mol)と言います。
この単位は化学で登場する新しい概念なので、苦手という方も多い印象ですね😥
1Lあたりに含まれる物質量(mol)を示すものがモル濃度(mol/L)なので、
公式は下記になります。
大阪ハイテクノロジー専門学校
バイオ・再生医療学科の特別イベントはこちら
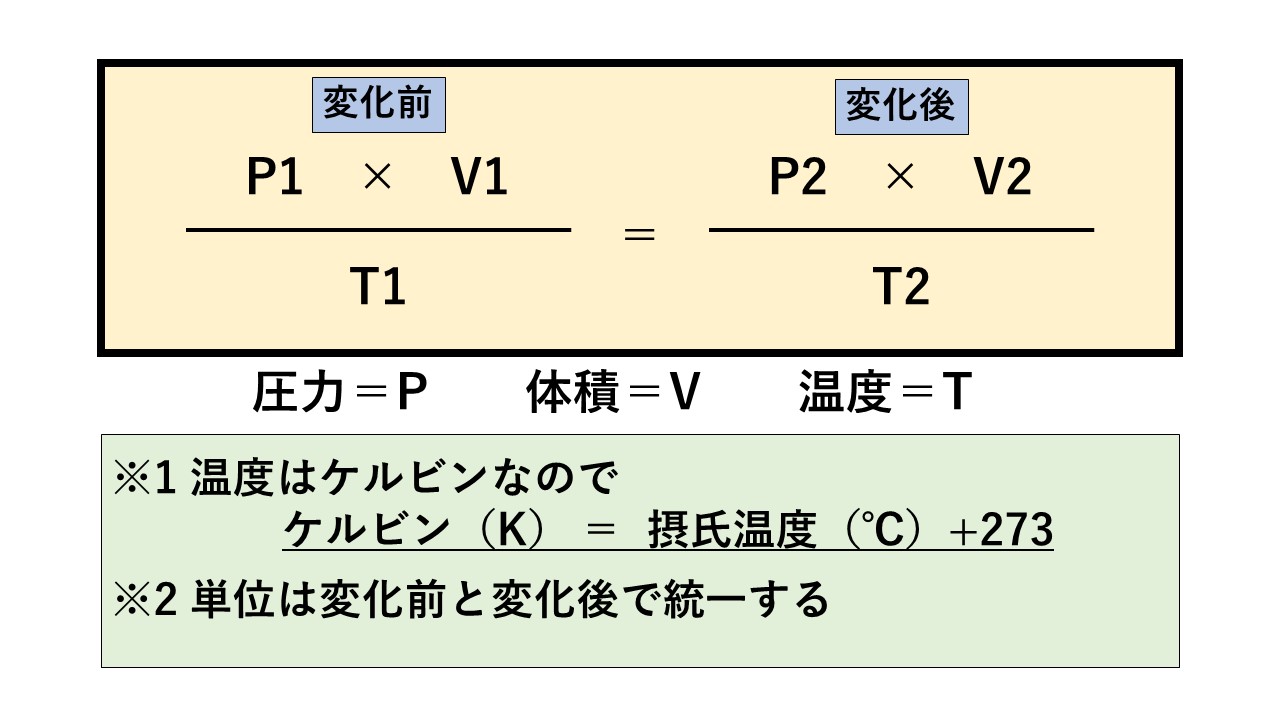
ボイル・シャルルの法則
気体の圧力・体積・温度が変化した際に、他の値はどうなるかを計算する公式です。
ボイルとシャルルの法則を合したものなので、この公式があればその2つにも対応可能。
問題文から公式に当てはまる単位を探して代入しましょう。
pHの計算
pHは水素イオン濃度を表している値です。
溶液のモル濃度、価数(HやOHの数)、電離度を用いて水素イオン濃度を計算します。
半端な値の場合は、logを用いて計算する必要があるので、数学の勉強が必要ですが、
水素イオン濃度が1.0×10nという形で表現できる場合は、
指数(n)がそのままpHになります。

以上3つに関しては、どんな理系大学・専門学校でも必須ですのでしっかり記憶していきましょう。
大阪ハイテクノロジー専門学校
バイオ・再生医療学科の特別イベントはこちら
さらにプラスアルファを覚えたい方は下記の4つも覚えておくとよいでしょう。
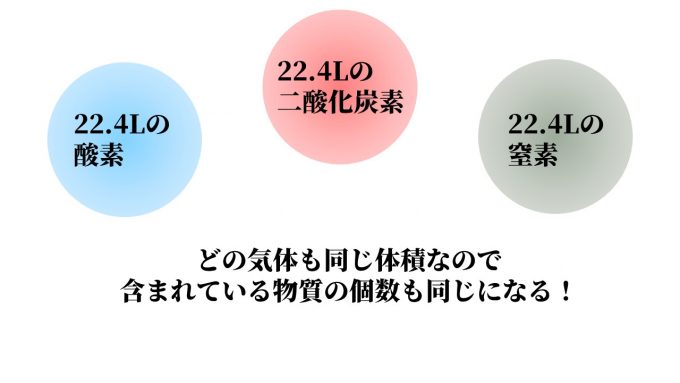
アボガドロの法則
「同一圧力、同一温度、同一体積のすべての種類の気体には同じ数の分子が含まれる」
この法則は、圧力と温度が同じ状態の異なる種類の気体があった場合、
それぞれを同じ体積ずつ集めれば、ともに同じ数の分子が含まれているという法則です。
たとえば、1Lの酸素と1Lの窒素を比べたとき、
酸素と窒素では分子の種類(酸素はO₂、窒素はN₂)が異なりますが、
それぞれ1Lの体積に入っている分子の数は同じということです。
ここをちゃんと理解するためには「モル(moL)」を知っておく必要があります。
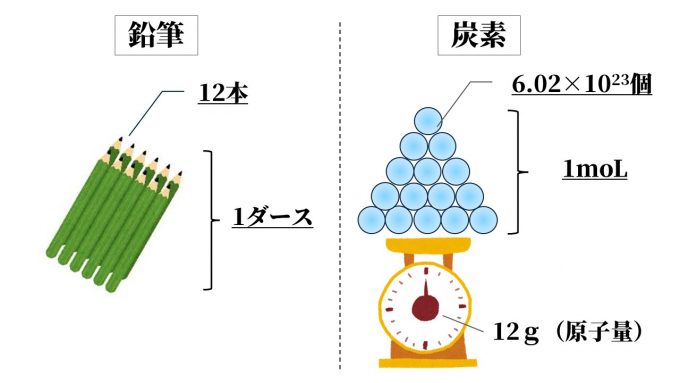
モル(moL)とは「物質の量」を表わす単位です。
アボガドロ定数に基づいており、1moLに含まれる物質の個数は6.02×10²³個です。
12本の鉛筆を1ダースとまとめて分かりやすく表記するのと同じ感覚で、
ある程度まとまった数(6.02×1023個)を集めたときの量が「1moL」です。
ちなみに同じ1ダースでも、えんぴつの種類によって1本あたりの重さが違いますよね。
なので、種類によって1ダースの重さも違ってきます。
この重さを表わすのが原子量や分子量です。
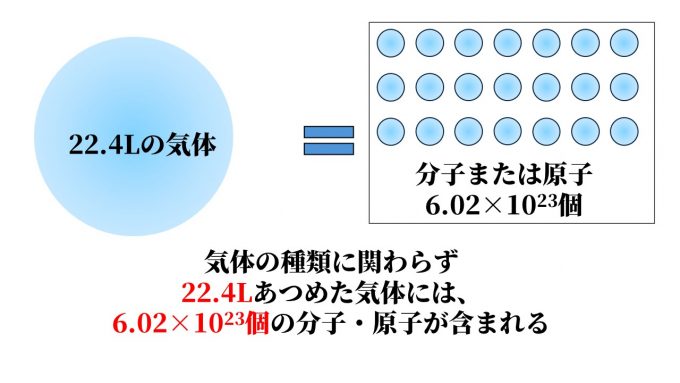
ここでアボガドロの法則に戻りますが、標準状態の気体は種類を問わず1moL= 22.4Lになります。
上記の1moL=6.02×1023個から、22.4Lの気体は6.02×1023個の分子・原子を含むということが分かります。(22.4L=1moL=6.02×1023個)
よって、気体の体積が同じであれば、そこには同数の分子や原子が含まれるということになるのです。
余談ですが
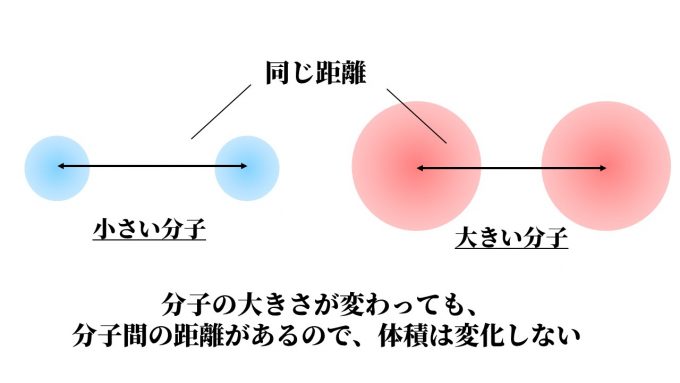
物質の種類が異なると、分子の大きさが違う=体積も変化するのでは?
と考える人もいるかもしれませんが、分子間の距離が非常に大きいため、
分子の大きさが多少異なっても距離で相殺され、見た目(体積)の影響はありません。
理想気体の状態方程式
公式は、 「PV=nRT」です。
これは、温度(T)、圧力(P)の条件下で、物質量(n)の理想気体が占める体積(V)を表わした式になります。
【各記号の説明】
P=圧力(Pa) V=体積(L) n=モル数(mol) T=絶対温度(K)
R=気体定数(8.31×103Pa・L/(K・mol))
4つの数字が分かっていれば、残った1つの数字を割り出すことができます。
「気体定数R」が出てきたら、この方程式を思い出すと良いでしょう。
ドルトンの分圧の法則
理想気体の「混合物の圧力は、各成分気体の分圧の和に等しい」という法則です。
正確には「混合気体において、どの気体ももう一方の気体の圧力に干渉しない」
=「各気体の圧力(分圧)は独立して計算されるし、混合気体の圧力(全圧)はすべての分圧の和になる」ということです。
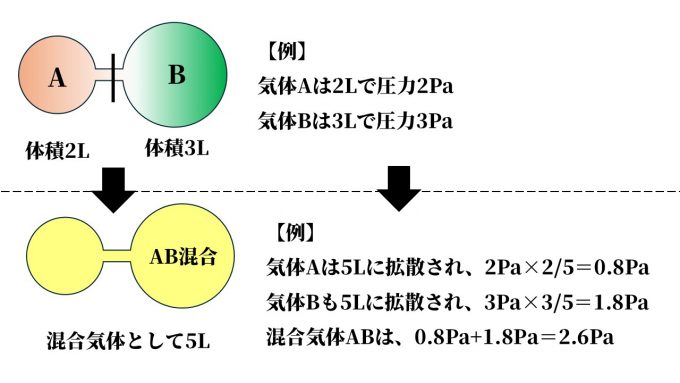
例えば、密栓されてつながった容器(仕切り有)にそれぞれ気体Aと気体Bが存在しているとします。
この2つを、真ん中の仕切りを取り外して混合させると、
混合気体の圧力は、混合後の各気体の圧力を足した値になります。
混合気体の圧力(P) = 気体Aの圧力(PA)+ 気体Bの圧力(PB)
注意するとすれば
・気体の圧力は1L単位であるということ。
例えば2Lで2Paの圧力を持つ気体を、5Lに拡散させた場合。
1Lで2Paの気体が2Lあるので、全体で2Pa×2=4Pa
それを5Lに分散させたので5分割、4Pa÷5=0.8Paとなります
【 圧力×拡散前の体積÷拡散後の体積 = 2Pa×2L÷5L 】
・混合気体の全圧は、混合されている気体の拡散後の圧力(Pa)を全部足すだけ!
こんな感じの考え方ができればバッチリではないでしょうか。
ヘスの法則
「化学反応の総熱量(エネルギー変化)は、反応の経路に依存せず、反応の初めと終わりの物質の状態だけに依存する」というものです。
簡単に説明すると、最初と最後の物質が同じであれば、どのような反応経路をたどっても、最終的なエネルギーの変化は同じになるということです。
下記の図のように
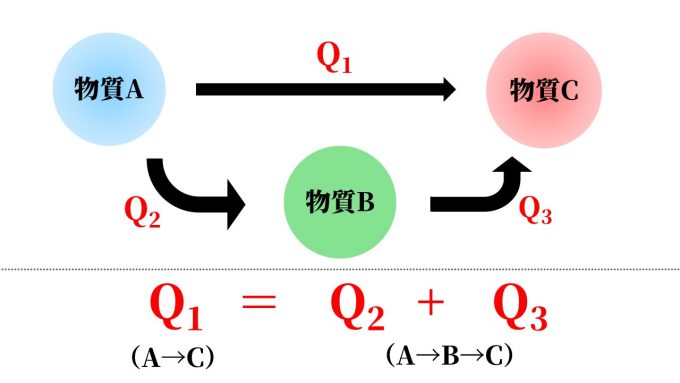
物質Aから物質Cを生成する化学反応があったとします。
このとき、物質Aから物質Bを迂回して物質Cを生成する別ルートがあった場合
A→Cの総熱量は、A→BとB→Cの迂回ルートを合計した熱量に等しくなります
この法則は反応熱や生成熱の計算だけでなく、結合エネルギーの計算にも使うことができるのでそちらも勉強しておきましょう。
バイオ・再生医療学科では、
理系・文系問わず、化学や生物、実験に興味がある入学生を募集中です😆✨
化学・生物は基礎からもう1度復習して専門分野の勉強に入るので
文系で化学を習っていなくても大丈夫!
文系を選択して悩んでいる方、理系だけど勉強が苦手…という方も、
興味があればぜひオープンキャンパスにお越しくださいね👨🔬




